陆益,于佳熙,梁政
(1.天津医科大学研究生院,天津 300070;
2.天津医科大学总医院耳鼻咽喉科,天津 300052)
膀胱癌是泌尿系统最常见的恶性肿瘤,在西方国家恶性肿瘤发病率中排名第5,在我国具有较高的复发率[1-2]。约50%接受根治性膀胱切除术的患者在术后2~3年内出现局部或远处复发,其中10%~15%被诊断为复发转移[3]。铂类联合化疗和肿瘤靶向药物并未对膀胱癌患者有最佳疗效,反而会引起严重不良反应[4-5]。然而,一种新药的研发和批准临床应用的过程既昂贵又耗时。因此,药物再利用近年来因在肿瘤治疗中取得了有效成果而受到关注[6-7]。盐酸氯丙嗪是抗精神病药物中具有代表性的吩噻嗪类药物,主要作用于中轴神经系统[8]。此外,研究发现氯丙嗪可以在肿瘤细胞系中发挥抗肿瘤作用,它可通过抑制丝苏氨酸蛋白激酶/雷帕霉素靶蛋白(Akt/mTOR)通路,诱导脑肿瘤细胞的凋亡和自噬,还可以直接与细胞色素氧化酶亚基4(COX4-1)结合,阻断耐药脑胶质瘤细胞的G1期[9-10]。氯丙嗪通过抑制组蛋白去乙酰化酶1(sirtuin 1)并激活p53在结直肠癌中发挥促凋亡的作用[11]。因此,氯丙嗪具有强大的抗肿瘤作用,但对膀胱癌是否具有抑瘤作用尚不清楚。Yes相关蛋白1(YAP1)是蛋白激酶Hippo通路的重要组成部分,与膀胱癌的增殖、迁移、侵袭和上皮间质转化(EMT)过程密切相关[12]。Ras相关蛋白1(RAP1)是RAS超家族的成员,属于RAP1的两个亚型之一[13],可参与肿瘤的形成并诱导EMT的发生[14],然而RAP1A在膀胱癌中的作用尚不完全清楚。因此,本研究旨在探索氯丙嗪对膀胱癌的抗肿瘤作用及其分子机制,为膀胱癌患者治疗的多向选择提供理论基础。
1.1 材料 人膀胱癌细胞BT-B细胞(天津市环湖医院)经STR鉴定;
氯丙嗪(Sigma公司);
胎牛血清(Gibco公司);
青霉素和链霉素(Sigma-Aldrich公司);
RPMI 1640培养基(Gibco公司);
MTT细胞增殖测定试剂盒(Solarbio公司);
抗体:YAP1(Santa公司,sc-101199),GAPDH(Abcam公司,ab8245),p-YAP1-ser127(CST公司,13008),RAP1A(CST公司,2399s),β-actin(Abcam公司,ab8227),N-cad(CST公司,13116)和Slug+snail(Abcam公司,ab180714);
逆转录试剂盒(Takara公司);
SYBR Green Master Mix试剂(启衡星);
YAP1、RAP1A和GAPDH的引物序列在北京奥科公司合成;
pCDH-YAP1和pCDHRAP1A为过表达质粒,Sh-RAP1A和Sh-YAP1为降表达质粒,均在实验室合成,pCDH-vector和plsi-vector分别作为过表达和降表达对照质粒由天津市肿瘤医院肿瘤研究所细胞生物学实验室捐赠,以上所有质粒通过测序确认;
转染试剂:ViaFect(Promega公司)。
1.2 方法
1.2.1 细胞培养 人膀胱癌细胞系BT-B由含有10%胎牛血清和1%的青霉素和链霉素的RPMI 1640培养基在37℃,5%CO2孵箱中培养。
1.2.2 MTT实验 实验分为对照组(0 μmol/L)和不同浓度氯丙嗪给药组(10、20、40、80 μmol/L);
将呈对数生长的细胞均匀种入96孔板,按照不同浓度氯丙嗪处理后,继续培养72 h,加入MTT培养基混合溶液(MTT∶培养基=1∶9),避光孵育4 h后除去MTT溶液并加入DMSO溶液,室温摇床避光孵育10 min后,分光光度计(Thermo公司)测定OD值。
1.2.3 划痕实验 实验分为对照组(0 μmol/L)和不同浓度氯丙嗪给药组(10、20 μmol/L),将呈对数生长的细胞均匀种入12孔板,氯丙嗪给药处理24 h,细胞融合度达到90%以上时画垂直迹线,继续培养,分别于24 h和48 h后在荧光显微镜下拍照。
1.2.4 Transwell迁移实验 实验分为对照组(0 μmol/L)和不同浓度氯丙嗪给药组(10、20 μmol/L),将两组细胞饥饿12 h,细胞计数得到所需细胞数。向24孔板中加入400 μL含血清的培养基,放置Transwell小室,然后将200 μL无血清细胞悬液种植在小室中并培养24 h。甲醇固定20 min,吉姆萨染液2染色15 min,吉姆萨染液3染色10 min,于显微镜下拍照。
1.2.5 蛋白免疫印迹实验 实验分为对照组(0 h)和不同时间段20 μmol/L氯丙嗪给药组(1、2 h),将呈对数生长的细胞均匀种入6孔板,配制蛋白裂解液(1.1×SDS+100×PMSF)于氯丙嗪给药处理1 h和2 h后分别收集蛋白,NanoDrop仪器测定浓度并均一,4%~12%预制胶进行蛋白电泳并使用快速转膜仪转入PVDF膜,5%脱脂牛奶室温封闭1 h,一抗抗体:YAP1(1∶500)、GAPDH(1∶2 000)、p-YAP1-ser127(1∶250)、RAP1A(1∶500)、β-actin(1∶2 000)、N-cadherin(1∶1 000)和Slug+Snail(1∶200)4℃过夜孵育。次日二抗抗体(1∶5 000)室温摇床孵育1 h,显影曝光。
1.2.6 免疫荧光实验 实验分为对照组(0 μmol/L)和氯丙嗪给药组(10 μmol/L),将呈对数生长的细胞均匀种入带有圆玻片的12孔板,氯丙嗪给药处理后分别于1 h和2 h终止药物作用,4%多聚甲醛(PFA)室温固定10 min,0.1% triton-100X室温渗透10 min,3%BSA封闭1 h,一抗抗体YAP1(1∶500)保湿盒4℃过夜孵育。次日加入荧光二抗(绿光488 nm,1∶200)避光室温孵育1 h,DAPI染核10~20 min,封片,蔡司共聚焦显微镜拍照。
1.2.7 RT-qPCR实验 实验分为对照组(0 μmol/L)和氯丙嗪给药组(20 μmol/L),将呈对数生长的细胞均匀种于6孔板中,氯丙嗪给药处理24 h。Trizol试剂提取RNA,Takara逆转录试剂盒合成cDNA,-20℃保存。设置PCR反应条件,在LC480荧光定量PCR仪上进行扩增和检测。反应条件为预变性:95℃,3 min;
变性:95℃,3 s;
退火:60℃,30 s;
共40个循环。目的基因引物序列见表1。

表1 RT-qPCR引物合成序列Tab 1 Primer sequencesfor RT-qPCR
1.2.8 质粒转染实验 实验分为对照组(vector组)和不同表达质粒转染组(pCDH-RAP1A组、Sh-RAP1A组、pCDH-YAP1组、Sh-YAP1组),将呈对数生长的细胞均匀种入12孔板,贴壁继续培养,配制转染体系(质粒∶转染试剂=1 mg∶3 μL)静置20 min,缓慢滴加转染体系,48 h后收集蛋白,蛋白免疫印迹步骤同上。
1.3 统计学处理 应用Prism8.0软件对数据进行分析和作图,蛋白免疫印迹结果应用Image J软件进行蛋白灰度分析,多组间数据比较采用单因素方差分析,两独立样本比较采用t检验分析,P<0.05为差异有统计学意义。
2.1 氯丙嗪对BT-B细胞增殖能力的作用 与对照组(0 μmol/L)相比,10 μmol/L氯丙嗪给药组(72.47±4.14,t=11.53,P<0.001)、20 μmol/L氯丙嗪给药组(63.98±1.74,t=35.83,P<0.000 1),40 μmol/L氯丙嗪给药组(41.03±2.83,t=36.1,P<0.000 1)和80 μmol/L氯丙嗪给药组(1.16±0.88,t=194.6,P<0.000 1)细胞72 h存活率均显著降低。氯丙嗪在浓度为10 μmol/L和20 μmol/L时显著抑制细胞生长,而在浓度为40 μmol/L和80 μmol/L时,细胞活力逐渐下降趋近于0,所以选择药物浓度10 μmol/L和20 μmol/L进行细胞功能实验验证。
2.2 氯丙嗪对BT-B细胞迁移能力的作用 划痕实验结果显示,与对照组(0 μmol/L)相比,10 μmol/L和20 μmol/L氯丙嗪给药组划痕24 h(t=5.80,P<0.01;
t=7.43,P<0.01)和48 h(t=5.13,P<0.01;
t=6.61,P<0.01)后细胞迁移率随药物浓度增加而降低(图1A、B);
Transwell迁移实验显示(图1C、D),与对照组(0 μmol/L)相比,10 μmol/L和20 μmol/L氯丙嗪给药组细胞24 h迁移穿过腔室的数目随药物浓度增加而减少(t=18.51,P<0.000 1;
t=19.04,P<0.000 1)。

图1 氯丙嗪BT-B细胞迁移能力的影响Fig 1 Effect of chlorpromazine on migration ability of BT-B cells
2.3 氯丙嗪对YAP1和RAP1A表达的影响 结果表明,与对照组(0 h)相比,氯丙嗪处理1 h和2 h后YAP1蛋白(t=6.12,P<0.05;
t=7.64,P<0.05)和磷酸化YAP1蛋白(t=6.47,P<0.05;
t=8.04,P<0.05)表达逐渐下降,2 h时下降明显(图2A、C、D);
与对照组(0 h)相比,RAP1A蛋白表达水平经氯丙嗪给药处理后也显著降低(t=4.87,P<0.05;
t=8.30,P<0.05;
图2B、E),与YAP1蛋白水平变化结果一致;
免疫荧光结果显示,与对照组(0 h)相比,氯丙嗪处理后2 h,YAP1在细胞核和细胞质内的荧光表达均明显变弱(图2F),与YAP1蛋白水平变化一致。
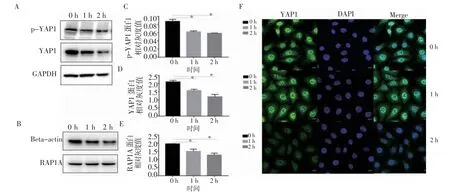
图2 氯丙嗪在BT-B中对YAP1和RAP1A表达的影响Fig 2 Effect of chlorpromazine on the expressions of YAP1 and RAP1A in BT-B cells
2.4 氯丙嗪对YAP1和RAP1A mRNA水平的影响RT-qPCR实验结果显示,与对照组(0 μmol/L)相比,20 μmol/L氯丙嗪给药组中YAP1和RAP1A的mRNA表达水平均显著降低(t=21.13,P<0.001;
t=40.59,P<0.001)(图3)。

图3 氯丙嗪在BT-B细胞中对YAP1和RAP1A mRNA表达水平的影响Fig 3 Effect of CPZ on the mRNA expressions of YAP1 and RAP1A in BT-B cells
2.5 YAP1和RAP1A与BT-B细胞EMT的调控关系 质粒转染结果显示,与对照组(vector组)相比,RAP1A过表达组(pCDH-RAP1A组)和RAP1A敲低组(Sh-RAP1A组)中YAP1的蛋白水平变化无统计学意义(P>0.05)(图4A、B)。如图4C、D和E所示:与对照组相比,YAP1过表达组(pCDH-YAP1组)中,RAP1A蛋白(t=9.05,P<0.05)表达增加,EMT相关标记分子N-cadherin蛋白(t=7.24,P<0.05)表达增加,Slug+snail蛋白(t=5.57,P<0.05)表达增加;
YAP1敲低组(Sh-YAP1组)中,RAP1A、N-cadherin和Slug+snail蛋白表达下降(t=4.36,P<0.05;
t=4.50,P<0.05;
t=4.49,P<0.05)。

图4 YAP1和RAP1A与膀胱癌EMT的关系Fig 4 Relationship between YAP1 and RAP1A and EMT in bladder cancer
高复发率和高转移率是膀胱癌患者预后不良的重要因素,尽管已经开发出多种靶向治疗药物,但由于存在严重的不良反应而难以进入临床使用[4,15-16]。药物再利用给肿瘤治疗提供了新的方向。氯丙嗪是美国食品药品监督管理局(FDA)批准的临床常用精神科药物,多项研究研究证明了氯丙嗪还具有抗肿瘤作用。早期研究证明,氯丙嗪与他莫昔芬联合用药可有效抑制乳腺癌中他莫昔芬耐药细胞的生长[17],还可以抑制口腔癌细胞的增殖并诱导G2/M期阻滞和细胞凋亡[6]。氯丙嗪可能通过靶向脯氨酸-谷氨酸-亮氨酸富集蛋白1(PELP1),抑制胃癌细胞的生长、迁移和侵袭[18]。氯丙嗪作为一种镇静药,在应用过程中可能会存在诱发膀胱癌的风险,但是其致病机制尚不明确,是否与给药剂量、疗程及方法相关也尚不完全明确[17]。有研究根据大规模数据库和系统回归建模分析构建了综合遗传和表观遗传网络(IGEN)分析,并预测出包括氯丙嗪、吉非替尼和多种化疗药物联合用药的治疗方案,用于治疗4期膀胱癌且不良反应最小[19]。因此,氯丙嗪对膀胱癌的作用仍然值得进一步探索。本研究探索了氯丙嗪对膀胱癌的抗肿瘤作用及其机制,为晚期膀胱癌患者的治疗提供了依据。
本研究证明了氯丙嗪对膀胱癌BT-B细胞有细胞毒性作用,并且对细胞迁移功能有抑制作用,以上结果说明了氯丙嗪对膀胱癌有抗肿瘤作用。同时本研究对其抑癌机制进行了进一步探索。实验结果显示氯丙嗪可显著降低YAP1和RAP1A的蛋白水平和mRNA表达水平,说明YAP1和RAP1A可作为氯丙嗪的下游靶点分子,氯丙嗪可能通过YAP1和RAP1A起到抑癌作用。免疫荧光实验结果显示,YAP1在细胞核和细胞质的荧光表达均变弱,与蛋白免疫印迹结果相符合,但无细胞亚定位的改变。YAP1的经典调控通路是上游分子哺乳动物STE20样激酶1/2(MST1/2)和大肿瘤抑制激酶1/2(LATS1/2)使YAP1发生磷酸化而失活,YAP1停留在胞浆中,不能入核激活下游靶基因[20]。因此,氯丙嗪下调YAP1的表达可能是通过非经典途径调控,具体机制有待探究。YAP1作为一个癌基因参与了多种肿瘤的发生、发展过程。研究证明YAP1和mTOR协同作用可促进膀胱癌细胞的增殖并抑制细胞凋亡[21]。维替泊芬通过靶向YAP1抑制膀胱癌细胞的增殖、迁移和侵袭[22]。YAP1在膀胱癌的发生中起重要作用,而氯丙嗪可抑制YAP1的表达,这与氯丙嗪通过YAP1抑制乳腺癌细胞的干性特性和迁移功能研究结果符合[7]。进一步说明了氯丙嗪对膀胱癌的抗肿瘤作用。此外,YAP1与膀胱癌EMT的发生密切相关。而RAP1A是细胞黏附相关分子,RAP1A可通过细胞外信号调节激酶/p38丝裂原活化蛋白激酶/Notch受体1(ERK/p38/Notch)通路诱导卵巢癌细胞EMT的发生,从而促进细胞迁移[23]。RAP1A作为长链非编码RNA——LINC00460的下游靶点分子,促进了鼻咽癌细胞的迁移和侵袭[24]。因此,氯丙嗪对膀胱癌BT-B细胞迁移功能的抑制作用可能是通过作用于YAP1和RAP1A实现的。此外,本研究对膀胱癌中YAP1和RAP1A与EMT的关系进行了探索。结果显示,YAP1通过RAP1A促进膀胱癌EMT的发生。磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)信号通路与膀胱癌EMT的发生相关[25],而YAP1和RAP1A通过PI3K/Akt信号通路诱导癌细胞EMT的发生[26]。YAP1正向调控RAP1A,研究证明,转录因子特异性蛋白1(Sp1)可与YAP1启动子多位点结合,诱导YAP1激活[27],并且RAP1A的激活也与Sp1密切相关[26]。研究结果提示,YAP1调控RAP1A可能与Sp1相关,需要进一步的实验验证。氯丙嗪是一种已在临床上使用数年的精神类药物,药物安全性高,可规避新药上市应用带来的研究瓶颈。本研究证明了氯丙嗪可通过YAP1调控RAP1A,抑制膀胱癌BT-B细胞的迁移,为降低膀胱癌患者的复发率和转移率以及改善患者预后提供了理论依据。
猜你喜欢氯丙嗪药组孔板核电厂高压安注系统再循环管线节流孔板的分析与改进核科学与工程(2022年3期)2022-10-18氯丙嗪在不同种属肝微粒体中代谢差异研究质谱学报(2022年3期)2022-06-15西药盐酸氯丙嗪的药理药效及临床合理应用世界最新医学信息文摘(2020年17期)2020-12-25精神分裂症患者采用氯氮平和氯丙嗪维持治疗的效果分析中华养生保健(2020年7期)2020-11-16牛肝菌多糖对力竭运动大鼠骨骼肌炎症反应的影响*中国食用菌(2020年9期)2020-11-11限流孔板的计算与应用广州化工(2020年6期)2020-04-18格列美脲联合胰岛素治疗2型糖尿病的临床效果观察医学食疗与健康(2019年6期)2019-09-10长距离矿浆管道系统中消能孔板的运行优化现代矿业(2018年9期)2018-10-16猪肉中有安眠药?健康博览(2017年7期)2017-09-30试论补阳还五汤中黄芪与活血药组的配伍意义中国中医药现代远程教育(2014年11期)2014-08-08